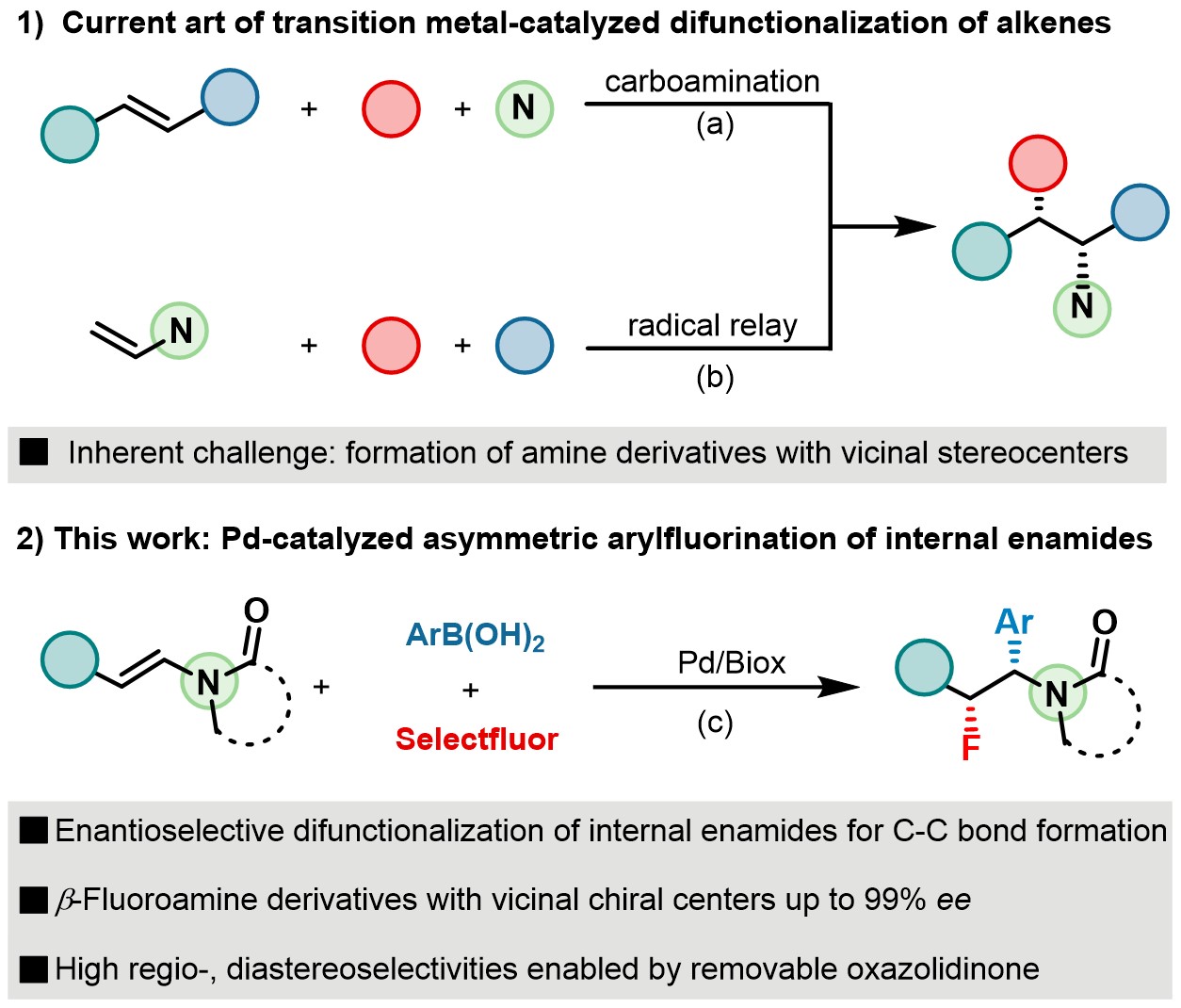
手性胺衍生物是有机化学中最普遍和最有价值的骨架之一🙆🏼,其中含两个连续手性中心的手性胺高效构筑尤其重要。近年来,过渡金属催化的烯烃不对称碳胺化反应成为手性胺合成的重要方法之一,该策略通常适用于端烯;对于更为普遍且更为惰性的内烯而言,反应的区域选择性和非对映选择性控制变得尤为困难(Scheme 1a)🧑🏽🏭🤽🏽♂️。在烯烃端预先引入含氮官能团,即烯胺衍生物的不对称双官能团化反应代表着另一类合成手性胺的策略🦸🏼🧑🏽✈️。近期,烯酰胺的不对称氢化和氢官能团化已经成为手性胺衍生物的重要合成方法👨🏼⚖️。因此🔕,过渡金属催化内烯酰胺三组分对映选择性双官能化反应在构建C–C键的同时保持反应的高区域选择性、高非对映选择性具有重要的科学意义(Scheme 1b)👨🏽🔧。
β-氟胺化衍生物常用作酶抑制剂、抗肿瘤和抗菌试剂,广泛应用于医药和农药等领域🚴🏼♀️。近日,我校陈宜峰课题组以简便易得的1,2-二取代烯酰胺作为起始原料💂🏼,通过钯催化的不对称1,2-芳基氟化反应,可以高区域选择性、高非对映选择性和高对映选择性的实现含有两个连续手性中心的β-氟胺化衍生物的模块化合成(Scheme 1c)。作者推测🤵🏻♂️,噁唑烷酮上的羰基作为导向基,诱导芳基钯物种区域选择性的迁移插入,形成稳定的苄基钯中间体🕺🏻,从而抑制β-H消除的过程,随后亲电氟化试剂将苄基钯物种氧化成钯(IV)中间体,最后经历还原消除的过程即可高效地实现含有连续两个手性中心的β-氟胺化合物的合成👩🏼🦰。该成果近期发表于Angew. Chem. Int. Ed.(DOI:10.1002/anie.202012882)。
https://doi.org/10.1002/anie.202012882