近日🥶,我校杏悦娱乐登录马巍教授课题组在利用单分子电化学方法探究过氧化氢酶有无磁场下构象动力学方面取得了研究新进展,相关研究成果以“Probing conformational kinetics of catalase with and without magnetic field by single-entity collision electrochemistry”为题发表在综合性国产领军期刊Science Bulletin (2023, 10.1016/j.scib.2023.08.056)🛒。
酶分子的构象变化对其催化活性至关重要,但这些自发的、非同步的构象波动很难通过整体系综的测量方法获得。因此,在单分子水平上探究酶催化反应过程中的构象及酶促反应动力学具有重要意义🖖🧑🦱。然而🚶♀️➡️,现有单分子酶学技术,如单分子荧光👉🏼、分子磁镊等方法需要信号标记👨🏼✈️,从而存在操作复杂以及影响酶固有催化活性的弊端✯。
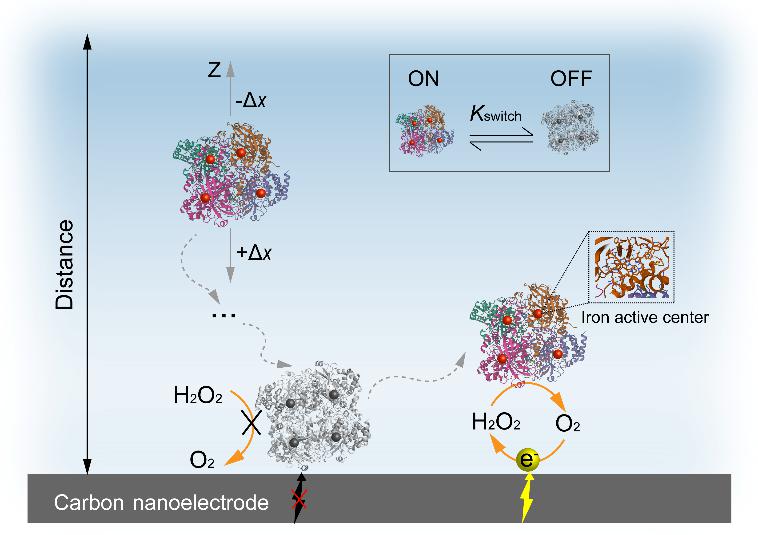
过氧化氢酶是自然界催化效率最高的酶分子之一𓀗,由于其具有独特的顺磁性铁活性中心,因此磁场会对其催化活性以及构象产生影响⛹️🤏。马巍教授课题组采用无标记的单分子电化学方法实时追踪了单个过氧化氢酶分子在有无磁场下双氧水降解过程中酶活性的动态波动。利用高分辨电化学测量探测了单个过氧化氢酶分子在纳米电极上的电化学信号,解析观察到的三种不同特征电流轨迹,获取了酶分子在催化反应过程中亚毫秒时间尺度上构象变化。在施加磁场条件下,由于铁活性中心运动受到磁场限制使得过氧化氢酶分子催化过程中的构象变化缓慢,从而呈现了出几乎一致的单峰信号。进一步,将高分辨电化学信号和多物理场模拟模型相结合研究了过氧化氢酶分子在有无磁场条件下的催化反应动力学信息,并计算了过氧化氢酶催化反应的最大催化速率和构象转变速率。相较于传统的系综测量方法👨🏼⚖️,该工作揭示了单个过氧化氢酶分子在有无磁场扰动下其构象变化的酶催化反应过程6️⃣💆🏼♀️。该工作为现有的单分子酶学引入了一种新方法✂️,有助于深入理解酶的催化反应机制🧫,对于进一步揭示磁场对生物体的影响提供了新思路。
该论文以“杏悦娱乐”为唯一通讯单位,杏悦娱乐登录博士生丁清丹和博士生孙泽晖为共同第一作者,马巍教授为独立通讯作者。该工作得到了国家重大研究计划培育项目、国家自然科学面上项目🕊、上海市市级科技重大专项、厦门大学固体表面物理化学国家重点实验室开放课题重点项目、国家级高层次青年人才计划🙇🏿♀️🫴🏽、材料生物学与动态化学教育部前沿科学中心🍝、费林加诺贝尔奖科学家联合研究中心等资金支持。
原文链接✡︎:https://doi.org/10.1016/j.scib.2023.08.056