近日🐈🛐,我校杏悦娱乐登录费林加诺贝尔奖科学家联合研究中心郭志前教授团队👨🏻🍳,在国际权威期刊《德国应用化学》发表VIP研究论文“Mapping Dynamic Protein Clustering with AIEgen-Active Chemigenetic Probe”,该论文同时被评为热点论文(Hot Paper),报道激活型化学遗传学荧光探针在活细胞监测蛋白质成簇/解聚动态过程的创新研究进展。
在蛋白质凝聚物研究领域🎢,由蛋白聚集折叠和天然蛋白质成簇是两类基本的生物学过程。特别是天然蛋白质成簇,在细胞命运决定和稳态维持中起到关键作用。然而♝,与蛋白误折叠引起蛋白质聚集(液液相分离或液固相分离聚集体)不同,蛋白质成簇更有可能成为非典型的相分离态,表现为聚集体微环境变化微小、显著的成簇/解聚可逆性,其独特的动态性和微环境特征对建立时空监测技术提出了重大挑战,而开发相应的示踪探针设计更成为关键核心(图1)📅🧑🏽✈️。迄今,对蛋白质成簇/解聚的可视化动态成像鲜有报道。
瞄准上述瓶颈难题,郭志前研究团队创制了“双边修饰”策略的激活型化学遗传学荧光探针🧑🏿,首次在活细胞中监测蛋白质成簇/解聚的精确状态(图2)。通过“双边修饰”策略🐺,在微环境敏感的喹啉腈染料一端修饰亲水磺酸基,另一端修饰可与目标蛋白质共价偶联的HaloTag配基,探针分子无论在水相环境中或是在亲脂性的生物环境(生物膜等)均能保持荧光暗态,克服了荧光探针易于非特异性点亮瓶颈难题🪻。
在与目标蛋白原位偶联后,探针突破性实现从蛋白聚集微粘度变化🥴、成簇动力学、聚集形貌三个维度揭示蛋白成簇/解离过程,为内质网应激相关的药物筛选提供了原位、动态、分子水平的生物学信息。探针对蛋白质的成簇表现出超低荧光背景与显著的检测信噪比,产生了显著的荧光点亮(信噪比高达67.5)🛌🏽,实现对IRE1蛋白成簇/解聚的可视化监测⛴:通过蛋白成簇/解聚动力学,解析急性与慢性内质网应激生物过程🙆🏻。
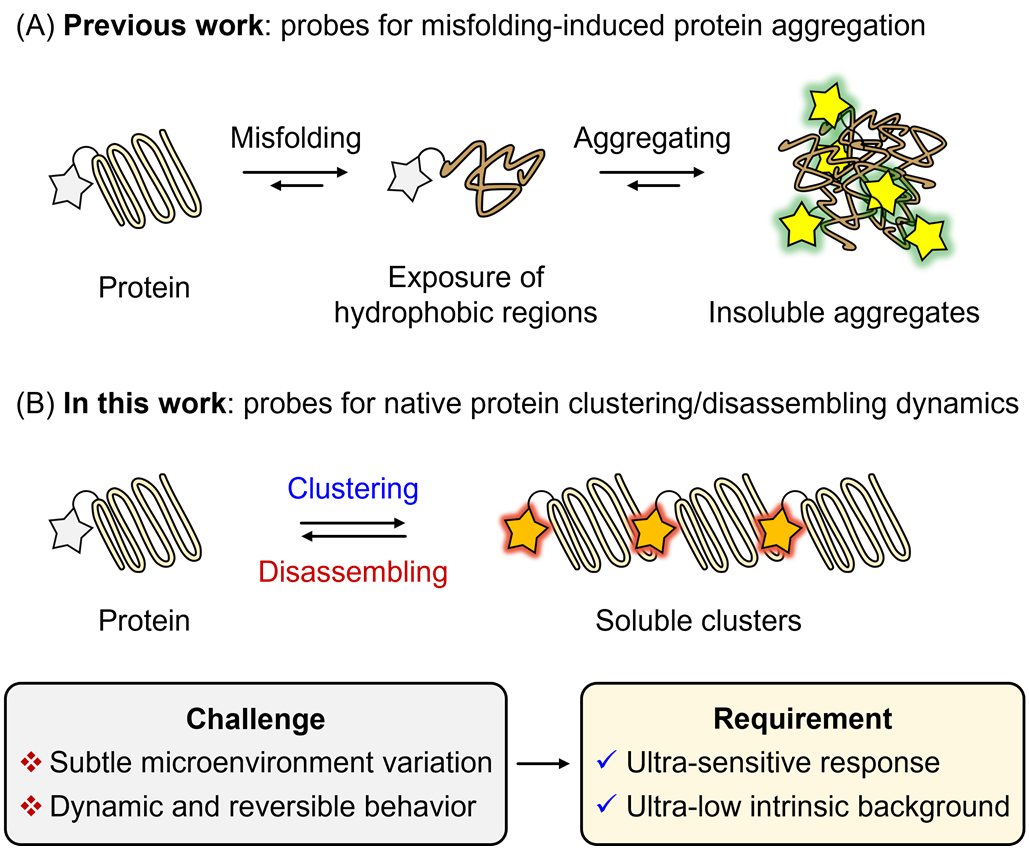
图1:蛋白质成簇检测挑战:聚集体微环境变化微小👩🏼🔬、显著的成簇/解聚可逆性

图2:从单边修饰到双边修饰的激活型化学遗传学荧光探针设计策略:降低荧光背景信号、减少非特异激活信号、提升响应灵敏度;实现对蛋白成簇/解聚的原位检测、蛋白成簇形貌成像🕎、内质网应激相关药物高效筛选。
该工作主要由我校杏悦娱乐登录燕宸旭副教授在郭志前教授的指导下完成,并得到了江南大学邵安东副研究员的大力支持。该工作还得到了国家杰出青年科学基金、基金委重大项目、材料生物学与动态化学教育部前沿科学中心⚓️、费林加诺贝尔奖科学家联合研究中心💆🏽♂️🕵🏼♂️、上海市“科技创新行动计划”启明星项目等资助和支持。
原文链接♟:https://onlinelibrary.wiley.com/doi/10.1002/anie.202422996